Szerző:
Mike Robinson
A Teremtés Dátuma:
7 Szeptember 2021
Frissítés Dátuma:
11 Lehet 2024
Tartalom
Az atomszám megfelel egy elem egyetlen atomjának magjában lévő protonok számának. Ez az érték nem változik; ezért felismerheti az izotóp egyéb jellemzőit, például a neutronok számát.
Lépések
2/2 rész: Az atomszám megkeresése
Keressen egy példányt a periódusos rendszerből. Kattintson ide, ha nincs elérhető. Minden elemnek megvan a maga atomszáma; így nincsenek hivatkozások a tartalom elsajátításához. Használjon egy táblázatot, vagy próbáljon megjegyezni.
- A legtöbb kémiai könyv táblázata a hátlapra van nyomtatva.

Keresse meg a táblázatban a vizsgált elemet. A legtöbb táblázat tartalmazza az elemek teljes nevét, valamint szimbólumaikat (Hg például a higany esetében). Ha nem találja meg azt, amit keres, lépjen be az internetre, és keressen rá a "kémiai szimbólum" kifejezéssel és az elem nevével.
Keresse meg az elem atomszámát. Általában az elem házának bal vagy jobb felső sarkában található, de más helyeken is előfordulhat. Ezenkívül mindig egész szám.- Ha a szám tizedespontot tartalmaz, akkor valószínűleg az atom tömegét jelzi.
Erősítse meg az információkat a közeli elemek szerint. A periódusos rendszer az atomszámok sorrendje szerint rendeződik. Ha például az Ön izotópszáma "33", akkor a bal oldali elem "32", a jobb oldalon pedig "34" lesz. Ebben az esetben azért, mert az atomszámot nézi.
- Ugrás van az "56" (bárium) és a "88" (rádió) elemek között. Az ennek a tartománynak megfelelő izotópok a táblázat alatti két sorban találhatók. Csak így vannak elkülönítve, hogy az asztal ne legyen túl nagy.

Értse meg, mit jelent az atomszám. Az atomszámnak egyszerű meghatározása van: a protonok mennyisége az elem atomjában. Ez a protonmennyiség pedig meghatározza a mag teljes elektromos töltését - ami következésképpen meghatározza, hogy az atom hány elektronot tölthet fel. Mivel az elektronok felelősek szinte minden kémiai kölcsönhatásért, az atomszám közvetetten befolyásolja az elem fizikai és kémiai tulajdonságait.- Más szavakkal, minden nyolc protonnal rendelkező atom megfelel egy oxigénatomnak. Két oxigénatomnak eltérő lehet a neutronjainak száma (vagy ha egy ion) vagy elektronja, de mindig mindegyikük nyolc-nyolc protont tartalmaz.
2. rész 2: Fontosabb információk felfedezése
Határozza meg az atomsúlyt. Általában a periódusos rendszer neve alatt szerepel, és két vagy három tizedesjegyű. Az atomtömeg az elem atomjainak átlagos tömegének felel meg, ami azt mutatja, hogyan található meg a természetben. "Atomtömeg-egységekben" ("u" vagy "u.m.a") mérik.
- Sok tudós inkább az "atomtömeg" kifejezést használja súly helyett.
Az atomtömeg megértése. Az atomtömeg fogalma nagyon hasonló a tömegéhez. A különbség az, hogy a tömeg az elem bármely atomjának átlagos tömegét jelzi, nem pedig egy adott atomot. Például: egy gramm vas több változó tömegű atomot tartalmaz; a tömeg a "relatív tömegüket" jelzi. Ha az elem egyetlen atomját tanulmányozza, akkor csak ismernie kell annak sajátos tömegét.
- Általában csak az atomokat érintő kémiai problémák már tájékoztatják az atomtömeg számát. Csak meg kell értenie azt a fogalmat, hogy ne érjen szabadon, ha más értéket lát.
Kerekítse a tömegszámot. A tömegszám megfelel az elem atomjában lévő protonok és neutronok teljes mennyiségének. Nem nehéz kiszámítani: csak vegye fel a periódusos rendszerre nyomtatott atomi tömeget és kerekítse a legközelebbi egész értékre.
- Ez azért működik, mert a neutronok és protonok mennyisége nagyon közel van az 1 u.m.a-hoz, míg az elektronoké nagyon közel a nullához. Az atomtömeg pontos számításokat tartalmaz a tizedesérték meghatározásához, de az egyetlen fontos adat az egész szám, amely megmondja, hány proton és neutron van.
- Ne feledje, hogy ha atomtömeget használ, akkor egy adott atom súlyával fog elrontani egy elemben. Például egy brómminta atomtömege 79 vagy 81.
Számítsa ki a neutronok számát. Most már tudod, hogy az atomszám megegyezik a protonok számával, és hogy a tömegszám megegyezik a protonok és a neutronok számának összegével. Egy elem neutronjának mennyiségének meghatározásához egyszerűen vonja le az atomszámot abból a teljes tömegből. Néhány példa:
- A héliumatom (He) tömegszáma 4, az atomszáma pedig 2. Ezért 4 - 2 = 2 neutron.
- Az ezüst (Ag) mintájának átlagos tömegszáma 108 (a periódusos rendszer szerint) és atomszáma 47. Átlagosan a minta minden egyes atomjának 108 - 47 = 61 neutron.
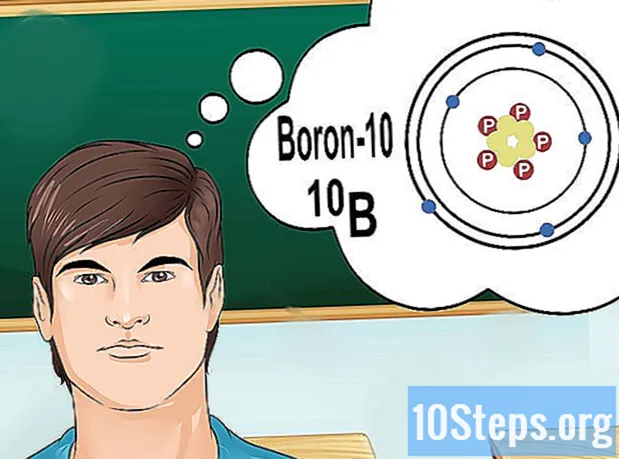
Ismerje meg az izotópokat. Az izotóp egy elem sajátos formája, amely számos neutront tartalmaz. Ha a megoldani kívánt probléma valami olyasmit hoz, mint a „bór-10” vagy a „B”, az azért van, mert a 10-es tömegszámú bór elemeiről beszél. Ezt az értéket használja, ne a „normál” értékeket. bórból.
- Az izotópok atomszáma soha nem változik. Egy elem minden izotópjának azonos számú protonja van.
Tippek
- Néhány nehezebb elem atomtömege zárójelben vagy szögletes zárójelben található. Ez azt jelenti, hogy ez a tömeg a legstabilabb izotóp pontos tömege, nem pedig több izotóp átlaga. Végül ez nem befolyásolja az elem atomszámát.