Tartalom
Egyéb szakaszokA kémia területén vegyérték elektronok azok az elektronok, amelyek egy elem legkülső elektronhéjában helyezkednek el. A vegyészek számára fontos ismeret annak ismerete, hogy miként lehet megtalálni a vegyérték-elektronok számát egy adott atomban, mert ez az információ meghatározza a kémiai kötések fajtáit, és így az elem reakcióképességét. Szerencsére csak egy elem periódusos rendszerére van szükség egy elem vegyérték elektronjának megtalálásához.
Lépések
2/2 rész: Valence elektronok keresése periódusos rendszerrel
Nem átmeneti fémek
Találni periódusos rendszer. Ez egy színkódolt, sokféle négyzetből álló táblázat, amely felsorolja az emberiség által ismert összes kémiai elemet. A periódusos rendszer sok információt tár fel az elemekkel kapcsolatban - ezen információk egy részét felhasználjuk arra, hogy meghatározzuk a vegyértékes elektronok számát a vizsgált atomban. Ezeket általában a kémiai tankönyvek borítóján találja. Van egy kiváló interaktív asztal is, amely online elérhető itt.

Jelölje meg az egyes oszlopokat az 1 és 18 közötti periódusos rendszerben. Általában a periódusos rendszerben egyetlen függőleges oszlop összes elemének azonos számú vegyértékelektronja lesz. Ha a periódusos rendszerben még nincs minden oszlop számozva, adjon mindegyiknek egy számot, kezdve 1-vel a bal szélső és 18-val a jobb szélső végén. Tudományos szempontból ezeket az oszlopokat elemnek nevezzük "csoportok".- Például, ha olyan periódusos táblázattal dolgozunk, ahol a csoportok nincsenek megszámozva, akkor egy 1-et hidrogén felett (H), egy 2-t a berillium felett (Be) írnánk, és így tovább, amíg egy 18-at nem írunk a hélium (He) fölé. .

Keresse meg elemét az asztalon. Most keresse meg az elemet, amelyhez meg szeretné találni a vegyérték elektronokat az asztalon. Megteheti ezt kémiai szimbólumával (az egyes dobozok betűivel), atomszámával (az egyes dobozok bal felső sarkában lévő számmal) vagy bármely más, az asztalon elérhető információval.- Például, keressük meg egy nagyon gyakori elem vegyérték elektronjait: szén (C). Ennek az elemnek az atomszáma 6. A 14. csoport tetején található. A következő lépésben megtaláljuk annak vegyértékelektronjait.
- Ebben az alfejezetben figyelmen kívül hagyjuk az átmeneti fémeket, amelyek a 3–12. Csoportok által készített téglalap alakú blokk elemei. Ezek az elemek kissé eltérnek a többitől, ezért az ebben az alfejezetben szereplő lépések nyertek ne dolgozzon rajtuk. Az alábbiakban lásd, hogyan kell kezelni ezeket.

Használja a csoportszámokat a vegyérték elektronok számának meghatározásához. A nem átmeneti fémek csoportszámával meg lehet találni a vegyérték elektronok számát az adott elem atomjában. Az a csoportszám egyes helyei az ezen elemek atomjában lévő vegyérték elektronok száma. Más szavakkal:- 1. csoport: 1 vegyérték elektron
- 2. csoport: 2 vegyérték elektron
- 13. csoport: 3 vegyérték elektron
- 14. csoport: 4 vegyérték elektron
- 15. csoport: 5 vegyérték elektron
- 16. csoport: 6 vegyérték elektron
- 17. csoport: 7 vegyérték elektron
- 18. csoport: 8 vegyértékű elektron (kivéve a héliumot, amelynek 2 van)
- Példánkban, mivel a szén a 14. csoportba tartozik, elmondhatjuk, hogy egy szénatom van négy vegyérték elektron.
Átmeneti fémek
Keressen egy elemet a 3–12. Csoportból. Amint azt fentebb megjegyeztük, a 3–12. Csoportba tartozó elemeket „átmenetifémeknek” nevezik, és másképpen viselkednek, mint a többi elem, ha valens elektronokról van szó. Ebben a részben elmagyarázzuk, hogy bizonyos mértékig gyakran nem lehet valencia elektronokat rendelni ezekhez az atomokhoz.
- Például válasszuk ki a Tantalum (Ta) 73. elemet. A következő néhány lépésben megtaláljuk a vegyérték elektronjait (vagy legalábbis próbáld ki nak nek.)
- Ne feledje, hogy az átmeneti fémek közé tartozik a lantanid- és aktinid-sorozat (más néven "ritkaföldfémek") - a két elemsor, amelyek általában a táblázat többi része alatt helyezkednek el, és amelyek lantánnal és aktiniummal kezdődnek. Ezek az elemek mind tartoznak 3. csoport a periódusos rendszer.
Értsd meg, hogy az átmenetifémeknek nincs "hagyományos" vegyérték elektronja. Annak megértése, hogy az átmenetifémek miért nem "működnek" úgy, mint a periódusos rendszer többi része, egy kis magyarázatot igényel az elektronok viselkedéséről az atomokban. A gyors áttekintést lásd alább, vagy hagyja ki ezt a lépést a válaszok eléréséhez.
- Ahogy az elektronok hozzáadódnak egy atomhoz, különböző "pályákra" válogatnak - alapvetően különböző területekre a mag körül, amelyekbe az elektronok összegyűlnek. Általában a vegyérték elektronok a legkülső héj elektronjai - más szavakkal, az utolsó hozzáadott elektronok .
- Kicsit túl bonyolult okok, amelyeket itt megmagyarázni lehet, amikor a legkülsőhöz elektronokat adnak d átmenetifém héja (erről bővebben alább), a héjba kerülő első elektronok általában normális vegyérték elektronként viselkednek, de ezt követően nem, és más orbitális rétegek elektronjai néha vegyérték elektronként működnek. Ez azt jelenti, hogy egy atomnak többféle vegyértékelektronja lehet, attól függően, hogy miként manipulálják.
Határozza meg a vegyérték elektronok számát a csoport száma alapján. A vizsgált elem csoportszáma ismét meg tudja mondani annak vegyértékelektronjait. Az átmeneti fémek esetében azonban nincs olyan minta, amelyet követhetne - a csoport száma általában megfelel a vegyérték elektronok lehetséges számainak tartományának. Ezek:
- 3. csoport: 3 vegyérték elektron
- 4. csoport: 2–4 vegyértékű elektron
- 5. csoport: 2–5 vegyértékű elektron
- 6. csoport: 2–6 vegyértékű elektron
- 7. csoport: 2-7 vegyérték elektron
- 8. csoport: 2 vagy 3 vegyértékű elektron
- 9. csoport: 2 vagy 3 vegyértékű elektron
- 10. csoport: 2 vagy 3 vegyértékű elektron
- 11. csoport: 1 vagy 2 vegyértékű elektron
- 12. csoport: 2 vegyérték elektron
- Példánkban, mivel a tantál az 5. csoportba tartozik, elmondhatjuk, hogy van közöttük kettő és öt vegyértékű elektron, a helyzettől függően.
2/2 rész: Valence elektronok keresése elektron konfigurációval
Tanulja meg, hogyan kell olvasni az elektronkonfigurációt. Az elem vegyérték elektronjának megtalálásának másik módja az úgynevezett elektronkonfiguráció. Ezek elsőre bonyolultnak tűnhetnek, de ez csak egy módja annak, hogy az elektronpályákat egy atomban betűkkel és számokkal ábrázolják, és könnyűek, ha tudják, mit néznek.
- Nézzünk meg egy példát a nátrium (Na) elem konfigurációjára:
- 1s2s2p3s
- Vegye figyelembe, hogy ez az elektronkonfiguráció csak egy ismétlődő karakterlánc, amely így működik:
- (szám) (levél) (szám) (levél) ...
- ...stb. Az (szám) (betű) a darab az elektronpálya neve és az az adott pályán lévő elektronok száma - ennyi!
- Például azt mondanánk, hogy a nátriumnak van 2 elektron az 1s pályán plusz 2 elektron a 2s pályán plusz 6 elektron a 2p pályán plusz 1 elektron a 3s pályán. Ez összesen 11 elektron - a nátrium a 11. elemszám, tehát ennek értelme van.
- Ne feledje, hogy minden alhéjnak van egy bizonyos elektronkapacitása. Elektronkapacitásuk a következő:
- s: 2 elektron kapacitás
- p: 6 elektron kapacitás
- d: 10 elektron kapacitás
- f: 14 elektron kapacitás
- Nézzünk meg egy példát a nátrium (Na) elem konfigurációjára:
Keresse meg a vizsgált elem elektronkonfigurációját. Miután megismerte az elem elektronkonfigurációját, a vegyértékelektronok számának megtalálása meglehetősen egyszerű (kivéve természetesen az átmenetifémeket.) Ha a konfigurációt a kezdéskor megkapja, akkor ugorhat a következő lépésre. Ha magának kell megtalálnia, lásd alább:
- Vizsgálja meg az oganesson (Og) 118. elem teljes elektronkonfigurációját, amely a periódusos rendszer utolsó eleme. Minden elemből a legtöbb elektron rendelkezik, így elektronkonfigurációja megmutatja az összes lehetőséget, amellyel más elemekben találkozhat:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Most, hogy ez megvan, csak annyit kell tennie, hogy megtalálja egy másik atom elektronkonfigurációját, csak töltse ki ezt a mintát az elejétől kezdve, amíg el nem fogy az elektron. Ez könnyebb, mint amilyennek hangzik. Például, ha meg akarjuk készíteni a klór (Cl) 17. elemének keringési diagramját, amelynek 17 elektronja van, akkor ezt tennénk:
- 1s2s2p3s3p
- Figyelje meg, hogy az elektronok száma összeadódik 17-re: 2 + 2 + 6 + 2 + 5 = 17. Csak a végső pályán kell megváltoztatnia a számot - a többi megegyezik, mivel a végső előtti pályák teljesen megteltek .
- Az elektronkonfigurációkról lásd még ezt a cikket.
- Vizsgálja meg az oganesson (Og) 118. elem teljes elektronkonfigurációját, amely a periódusos rendszer utolsó eleme. Minden elemből a legtöbb elektron rendelkezik, így elektronkonfigurációja megmutatja az összes lehetőséget, amellyel más elemekben találkozhat:
Rendeljen elektronokat az orbitális héjakhoz az Octet szabály segítségével. Ahogy az elektronok hozzáadódnak egy atomhoz, különféle pályákra esnek a fent megadott sorrend szerint - az első kettő az 1s pályára, az utána következő kettő a 2s pályára, az utána lévő hat a 2p pályára kerül, és hamar. Amikor az átmenetifémeken kívüli atomokkal van dolgunk, azt mondjuk, hogy ezek a pályák "orbitális héjakat" képeznek a mag körül, és mindegyik egymást követő héja távolabb van, mint az előző. A legelső héjon kívül, amely csak két elektron befogadására képes, mindegyik héjnak nyolc elektronja lehet (kivéve ismét, ha átmenetifémekkel foglalkozunk.) Ezt nevezzük Octet-szabály.
- Tegyük fel például, hogy a Boron (B) elemet nézzük. Mivel atomszáma öt, tudjuk, hogy öt elektronja van, és elektronkonfigurációja így néz ki: 1s2s2p. Mivel az első orbitális héjnak csak két elektronja van, tudjuk, hogy a Boronnak két héja van: az egyikben két 1s elektron található, a másikban pedig a 2s és a 2p orbitális három elektron van.
- Másik példaként egy olyan elemnek, mint a klór (1s2s2p3s3p) három orbitális héja lesz: az egyik két 1s elektronval, egy két 2s és hat 2p elektronral, egy pedig két 3s és öt 3p elektrondal rendelkezik.
Keresse meg az elektronok számát a legkülső héjban. Most, hogy ismeri elemének elektronhéját, a vegyértékes elektronok megtalálása egyszerű: csak használja a legkülső héjban lévő elektronok számát. Ha a külső héj tele van (más szóval, ha nyolc elektronja van, vagy az első héjához kettő), akkor az elem inert és nem reagál könnyen más elemekkel. Ismételten azonban a dolgok nem teljesen követik ezeket a szabályokat az átmenetifémekre vonatkozóan.
- Például, ha a Boronnal dolgozunk, mivel a második héjban három elektron van, akkor azt mondhatjuk, hogy a Boron három vegyérték elektronok.
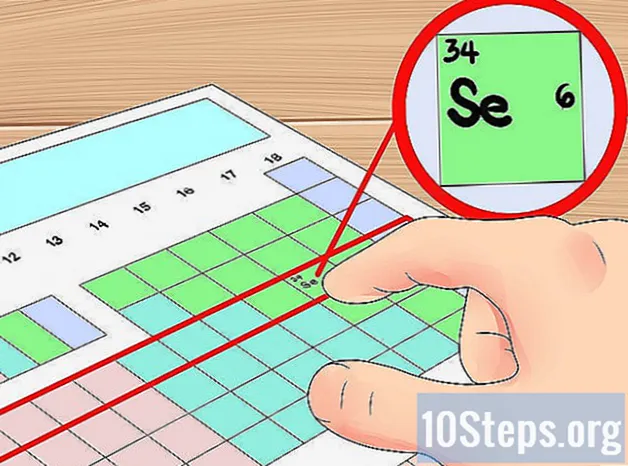
Használja a táblázat sorait orbitális shell parancsikonként. A periódusos rendszer vízszintes sorait elemnek nevezzük "időszakok". A táblázat tetejétől kezdve minden periódus megfelel a pontok számának elektronhéjak a korabeli atomok rendelkeznek. Ezt használhatja parancsikonként annak meghatározásához, hogy egy elem hány vegyértékelektronnal rendelkezik - csak az elektronszámláláskor kezdje a periódus bal oldalától. Ismételten figyelmen kívül akarja hagyni az átmenetifémeket ezzel a módszerrel, amely magában foglalja a 3–12 csoportokat.
- Például tudjuk, hogy a szelén elemnek négy orbitális héja van, mert a negyedik periódusban van. Mivel ez a negyedik periódus bal oldali hatodik eleme (figyelmen kívül hagyva az átmeneti fémeket), tudjuk, hogy a külső negyedik héj hat elektronral rendelkezik, és így a szelén hat vegyérték elektron.
Közösségi kérdések és válaszok
Hogyan számoljuk ki a vegyértékelektront?
A vegyérték elektronokat az elemek elektronikus konfigurációjának meghatározásával lehet megtalálni. Ezt követően a legkülső héjban lévő elektronok száma megadja az adott vegyérték-elektronok számát.
Ha egy atomnak 33 elektronja van, hány vegyérték-elektron van?
Ha az atom nem ion, akkor azt mondhatjuk, hogy az atomnak 33 protonja van. Ez azt jelenti, hogy a 33. elem az arzén. Akkor tudjuk, hogy ez nem átmeneti fém, ezért megkeressük és megtaláljuk, hogy csoportszáma egységjegye 5, ami azt jelenti, hogy 5 vegyértékelektronja van.
Hogyan határozhatom meg a hélium atomszámát?
A protonok száma megegyezik az atomszámmal.
Miért nyernek az elektronok negatív és nem pozitív töltést?
Az atomok elektronokat, negatív töltéseket nyernek vagy veszítenek, mivel a protonok pozitív töltéssel rendelkeznek, és az erős nukleáris erő tartja őket a magban. Ez az univerzum négy elkülönülő erejének egyike: a gravitáció, az elektromágnesesség, a gyenge és az erős nukleáris erő. Erősnek kell lennie, mert a protonok taszítják egymást, mégis nagyon közel vannak egymáshoz a magban (a neutronokkal együtt, amelyeket az erős erő is tart.) Az ötlet az, hogy az erős erő rendkívül erős, de csak nagyon apró távolságokon. Gondolj apró szuper erős kampókra. Ahhoz, hogy a protonok és a neutronok összekapcsolódjanak, olyan erőkre van szükség, mint egy csillag, egy szupernóva vagy atomrobbanás hatalmas gravitációja.
Mi a nemesgázok valance elektronja?
A nemesgázoknak nyolc vegyérték elektronja van - ez az elem legstabilabb állapota.
Miért van a nitrogénnek 6 vegyértékű elektronja, de a 15. csoportba tartozik?
A nitrogénnek csak öt vegyértékű elektronja van, mivel az 5. csoportba tartozik, bár valójában a 15. csoportba tartozik, figyelmen kívül hagyja az átmeneti fémeket, mert ezek a csoportok eltérő módon határozhatják meg vegyérték-elektronjaikat. Ezért: a 13. csoport a 3. csoportot jelenti, és így tovább.
Egy atomnak 7 protonja, 8 neuronja és 7 elektronja van. Mennyi az elektron a vegyértékű héjában?
A 7 protont tartalmazó elem a nitrogén. A nitrogén azon elemoszlopban van, amelynek 5 elektronja van a vegyértékhéjban. A neutronok számának nincs jelentősége a vegyérték elektronok számának megállapításához egy adott elemben.
Hol vannak a periódusos rendszerben az atomok, amelyek hét külső héj elektronnal rendelkeznek?
Nézze meg a jobb oldali második-utolsó oszlopot, az inert gázok mellett.
Mi az a vegyérték elektron?
A vegyérték elektron egy olyan elektron, amely az atom legkülső részén található, és megosztható vagy felvehető a reakció során.
Miért vannak a periódusos rendszer elemei különböző számú vegyérték elektronokkal?
Különböző kémiai szerkezetük van. A vegyértékes elektronok hozzák létre a kémiai reakciókat.
Tippek
- Ne feledje, hogy az elektronkonfigurációk egyfajta rövidítéssel írhatók nemesgázok (a 18. csoport elemei) használatával, hogy állítsák be a pályákat a konfiguráció elején. Például a nátrium elektronkonfigurációja írható 3s1 - lényegében ugyanaz, mint a neon, de még egy elektron van a 3s pályán.
- Az átmenetifémeknek lehetnek valens alhéjai, amelyek nincsenek teljesen kitöltve. Az átmenetifémekben a vegyérték elektronok pontos számának meghatározása a kvantumelmélet alapelveit vonja maga után, amelyek túlmutatnak a cikk keretein.
- Vegye figyelembe, hogy a periódusos rendszer országonként eltér. Tehát kérjük, ellenőrizze, hogy a megfelelő, frissített verziót használja-e a félreértések elkerülése érdekében.
- Ügyeljen arra, hogy tudja, mikor kell hozzáadni vagy kivonni az utolsó pályát a vegyérték elektronok megtalálásához.
Amire szüksége lesz
- Periódusos rendszer az elemek
- Ceruza
- Papír
A wikiHow minden nap keményen dolgozunk azon, hogy hozzáférést nyújtsunk az utasításokhoz és információkhoz, amelyek segítenek a jobb életben, legyen az biztonságosabb, egészségesebb vagy a közérzet javítása. A jelenlegi közegészségügyi és gazdasági válságok közepette, amikor a világ drámaian változik, és mindannyian tanulunk és alkalmazkodunk a mindennapi élet változásaihoz, az embereknek minden eddiginél nagyobb szükségük van a wikiHow-ra. Támogatása segít a wikiHow-nak alaposabb illusztrált cikkek és videók létrehozásában, valamint megbízható oktatási tartalmú márkánk megosztásában emberek millióival a világ minden tájáról. Kérjük, fontolja meg, hogy ma hozzájárulna a wikiHow-hoz.


